Introducción
La química, como tal, es una ciencia relativamente reciente. En épocas muy antiguas se desarrollaban ciertos procesos químicos sin tener plena conciencia de lo que se hacia.
Para citar solo algunos casos, podemos citar al fuego que fue utilizado por primera vez por el hombre prehistórico para cocinar sus alimentos y para desinfectar heridas. Aunque seguramente el hombre prehistórico no tenía idea de los procesos químicos envueltos en esas actividades, sí pudo apreciar sus efectos. En un principio, fue necesario utilizar armas para cazar sus alimentos.
Pero, las armas estaban elaboradas con materiales, tal como el hierro, que son poco resistentes a ciertas reacciones químicas (como la oxidación), por lo que se dañaban con mucha rapidez. La química logró mejorar enormemente este material gracias a otro proceso químico en el cual se utilizó una mezcla que incluían al hierro y al carbón para conformar una aleación mucho más resistente: el acero.
Más adelante, se aprovecharon los procesos y la reacciones químicas para producir materiales como vidrio, jabón, medicamentos, perfumes, cosméticos tintes, vinos, y muchos otros. La elaboración de cada uno de estos materiales siempre traía implícita la ejecución de algún proceso de naturaleza química.
Entre los pensadores que dieron algún aporte que permitieron el surgimiento de la química como una ciencia podemos contar a Aristóteles, Tales de Mileto, Heráclito, Leucipo, Demócrito, y muchos otros. Lo importante es que por pequeños que hayan podido ser sus aportes, estos lograron que la química diera un paso adelante hacia su consolidación como ciencia.
Un fenómeno en la historia que fue fundamental para llegar a lo que hoy conocemos como ciencia química, fue el surgimiento de la alquimia. Se piensa que la alquimia probablemente surgió en el siglo I, estando geográficamente ubicado en China, Grecia y la India, y alcanzando su máximo desarrollo en la edad media. Los alquimistas desarrollaron cientos de experimentos químicos en la búsqueda de la conversión del plomo en oro. Crear una sustancia capaz de lograr esta conversión involucró solo fracasos para los alquimistas, pero se consiguieron muchas sustancias químicas útiles que son de uso común aún hoy día. Algunos de los procedimientos químicos desarrollados por los alquimistas fueron las técnicas de destilación, la cristalización, la sublimación, la metalurgia y la calcinación. Los alquimistas se vieron limitados por la poca cantidad de procedimientos químicos existente, por lo que se vieron forzados a inventar dispositivos químicos como el alambique (muy útil para la destilación), el "baño de maría" (que permite calentar un material sin sobrepasar los 100º centígrados) y el agua regia (que consistía en una mezcla de ácidos). Al observar la utilización de todos estos elementos por los alquimistas se hace razonable aceptar que ellos fueron los verdaderos predecesores de la ciencia química.
Actualmente, se considera como padre de la química moderna a Antoine Lavosier, quien sostuvo la rigurosidad del método cuantitativo, destruyó la antigua teoría del flogisto (la cual trataba de explicar porque ardían los materiales) y propuso la Ley de Conservación de la Materia.
La edad de oro de la química se presentó en el siglo veinte. La química se amplió en ese siglo de tal manera que fue preciso dividirla en varias ramas. A pesar de esto, se hace necesario entender la química desde varios puntos de vista, ya que está íntimamente relacionada con otra ciencias como la física, la medicina, la ingeniería y otras.
La química es indispensable en las industrias de alimentos, en la industria de medicinas, en las industrias textiles, en las industrias de cosméticos, en las industrias de detergentes, en las industrias de insecticidas, etc.
Hoy en día se conceptualiza la química como una ciencia experimental que estudia la estructura de la materia, sus propiedades y sus transformaciones, así como que investiga y enuncia las leyes que rigen sus cambios.







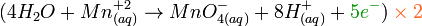



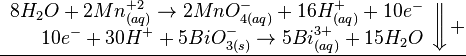
 .
.