Medio ácido
En medio ácido se agregan hidronios (cationes) (H+) y agua (H2O) a las semirreacciones para balancear la ecuación final.
Del lado de la ecuación que haga falta oxígeno se agregarán moléculas de agua, y del lado de la ecuación que hagan falta hidrógenos se agregarán hidronios.
Por ejemplo, cuando el Manganeso (II) reacciona con el Bismutato de Sodio.Ecuación sin balancear:



- Reducción:

- Oxidación:
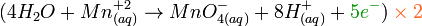
Reducción:

Al final tendremos:
Oxidación:

Reducción:

Como se puede ver, los electrones están balanceados, así que procedemos a sumar las dos semirreacciones, para obtener finalmente la ecuación balanceada.
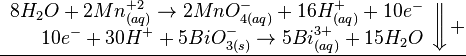
 .
.
No hay comentarios:
Publicar un comentario