Medio Básico
En medio básico se agregan iones hidróxilo (aniones) (OH−) y agua (H2O) a las semirreacciones para balancear la ecuación final.
Por ejemplo, tenemos la reacción entre el Permanganato de Potasio y el Sulfito de Sodio.
Ecuación sin balancear:

Separamos las semirreacciones en
Oxidación: 

Reducción: 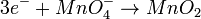
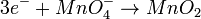
Agregamos la cantidad adecuada de Hidróxidos y Agua (las moléculas de agua se sitúan en donde hay mayor cantidad de oxígenos).
Oxidación: 

Reducción: 
Balanceamos la cantidad de electrones al igual que en el ejemplo anterior.

Balanceamos la cantidad de electrones al igual que en el ejemplo anterior.
Oxidación: 

Reducción: 
Obtenemos:

Obtenemos:
Oxidación: 

Reducción: 
Como se puede ver, los electrones están balanceados, así que procedemos a sumar las dos semirreacciones, para obtener finalmente la ecuación balanceada.


Como se puede ver, los electrones están balanceados, así que procedemos a sumar las dos semirreacciones, para obtener finalmente la ecuación balanceada.


Reglas para determinar el Estado de oxidación, EDO:
- El estado de oxidación del átomo en un elemento es cero. Ejemplos: O en O2, H en H2, Al en el metal, etc. En todos ellos el EDO=0.
- El EDO de un ión monoatómico es idéntico a su carga. Por ejemplo, para el Cu2+ el EDO del Cu es +2, para el Cl-, el EDO del Cl es –1.
- Los metales alcalinos siempre que estén formando parte de un compuesto tienen EDO +1, y los metales alcalinos térreos tienen EDO +2 cuando están formando parte de un compuesto.
- Los halógenos, cuando forman parte de una sal binaria, tienen EDO –1 y los no metales calcógenos, cuando forman parte de una sal binaria, tienen EDO –2.
- El estado de oxidación del hidrógeno, cuando está formando parte de un compuesto, tiene EDO +1, excepto en los hidruros metálicos donde el EDO es –1.
- El estado de oxidación del oxígeno en los compuestos es –2, con excepción de los peróxidos; por ejemplo, en el peróxido de hidrógeno o agua oxigenada, H2O2, o en los peróxidos de los metales alcalinos, de fórmula general M2O2 y en los peróxidos de los metales alcalino térreos, de fórmula MO2 donde el EDO del oxígeno es –1.
- La suma de los estados de oxidación de los átomos componentes de una molécula neutradebe ser igual a cero, e igual a la carga en el caso de los iones poliatómicos.
Es importante tener claro los conceptos de oxidante, reductor, semirreacción de oxidación y semirreacción de reducción.
- Agente Reductor: es la sustancia que contiene el elemento cuyo EDO aumenta. Esta sustancia se oxida y reduce a la otra sustancia.
- Agente Oxidante: es la sustancia que contiene el elemento cuyo EDO disminuye. Esta sustancia se reduce y oxida a la otra sustancia.
- Semirreacción de oxidación: es el proceso en que un elemento aumenta su EDO, para lo que es necesario que el agente reductor ceda electrones.
- Semirreacción de reducción: es el proceso en que un elemento disminuye su EDO, para lo que es necesario que el agente oxidante capte electrones.
No hay comentarios:
Publicar un comentario