¿Que Sucede en Oxido reducción?
Un átomo neutro cualquiera tiene un número definido de electrones, el cual corresponde al número de portones que posee su núcleo; es decir, tiene tantos electrones como el valor de su número atómico.
Por ejemplo:
H Z = 1; es decir 1 protón y 1 electrón
Na Z = 11; es decir 11 protones y 11 electrones
I Z = 53; es decir 53 protones y 53 electrones
Generalmente, cuando un elemento determinado se combina a través de una reacción química, el número de electrones que está asociado a él, puede ser mayor o menor que su número atómico característico. De aquí nace el concepto de estado de oxidación o número de oxidación. Lo que simplemente significa, el número de electrones en exceso o de déficit que se le asigna a un elemento con respecto a su número atómico, cuando forma parte de un compuesto o está en forma de ión.
Reacciones de óxido reducción o redox: Son aquellas reacciones en las cuales los átomos experimentan cambios del número de oxidación. En ellas hay transferencia de electrones y el proceso de oxidación y reducción se presentan simultáneamente, un átomo se oxida y otro se reduce. En estas reacciones la cantidad de electrones perdidos es igual a la cantidad de electrones ganados.
Número de oxidación o estado de oxidación: es el número que se asigna a cada tipo de átomo de un elemento, un compuesto o ión, y que representa el número de electrones que ha ganado, perdido o compartido. El número se establece de manera arbitraria, pero su asignación se basa en diferentes postulados
Existen diferentes definiciones sobre oxidación y reducción:
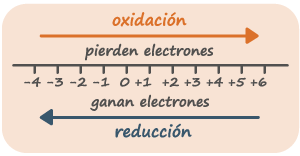
Oxidación: es un incremento algebraico del número de oxidación y corresponde a la perdida de electrones. También se denomina oxidación la pérdida de hidrógeno o ganancia de oxígeno.
Reducción: es la disminución algebraica del número de oxidación y corresponde a la ganancia de electrones. Igualmente se define como la pérdida de oxígeno y ganancia de hidrógeno.
Agente Oxidante: Es la sustancia que se reduce (gana e-) provocando la oxidación.
Una sustancia sufre una oxidación cuando pierde electrones.Por lo tanto una oxidación es ahora definida como la pérdida de uno o más electrones por una substancia (elemento, compuesto, o ión) . Una sustancia sufre reducción cuando gana electrones
Por ello una reducción es definida como la ganancia de uno o más electrones por una sustancia.
En toda reacción de oxido-reducción (abreviadamente reacciones redox):
- El oxidante gana electrones, mientras que el reductor los pierde.
- Durante la reacción, el reductor se oxida y el oxidante se reduce.
De esta manera todo proceso de oxidación está vinculado necesariamente a otro proceso complementario de reducción: en un sistema químico para que una sustancia ceda electrones, otra tiene que captarlos.
Así, una reacción de oxido-reducción o reacción redox, es un proceso en el cual los electrones son transferidos de una sustancia a otra i.e. una reacción de transferencia de electrones.
No hay comentarios:
Publicar un comentario